Le cerveau se trouve sous la dépendance d’un apport continu de glucose et d’oxygène par le sang circulant. Lorsque le débit sanguin chute au-dessous d’une certaine limite, la combinaison d’une hypoperfusion et d’un déficit énergétique conduit à un arrêt réversible du fonctionnement neuronal dans la zone affectée, appelée pénombre ischémique. Le devenir de cette zone dépend de la restauration précoce de la perfusion cérébrale. Lorsqu’elle s’accentue ou se prolonge, l’ischémie entraîne la mort, ou nécrose, du tissu cérébral. On appelle infarctus cérébral un foyer d’ischémie cérébrale associant des zones de nécrose et de pénombre. Ces accidents vasculaires cérébraux (AVC) ischémiques surviennent, pour la plupart, dans un contexte d’athérothrombose le plus souvent située au niveau de la bifurcation de l’artère carotide primitive et qui se prolonge sur les premiers centimètres de l’artère carotide interne. Les mécanismes par lesquels ces lésions athéromateuses provoquent une ischémie cérébrale sont multiples : formation d’un thrombus obstruant l’artère au niveau de la lésion elle-même (accident thrombotique), détachement d’un fragment de plaque d’athérothrombose allant emboliser brutalement une artère distale, ces événements étant probablement associés à des anomalies hémodynamiques. L’analyse systématique de ces mécanismes par des techniques d’imagerie et par des méthodes biologiques reflétant la physiopathologie des lésions devrait aboutir à l’identification de biomarqueurs permettant de prévoir la survenue d’accidents ischémiques, ou, dès que la thrombose est constituée, d’éviter l’évolution dans la zone de pénombre ischémique vers la mort du tissu. En effet, la stimulation et l’activation cellulaires dans la zone de pénombre (par exemple par des stimulus oxydatifs), les interactions cellulaires avec les cellules inflammatoires au sein des lésions de la zone infarcie, se manifestent par la libération de médiateurs bioactifs solubles et de fragments membranaires, ces derniers dénommés microparticules cellulaires (MP). Leur identification dans le sang circulant (surtout si elle est faite de façon préventive avant la survenue de l’accident ischémique ou au cours des accidents transitoires), représente un atout majeur dans le diagnostic et le traitement des accidents ischémiques. Nous décrivons ici l’apport relatif de marqueurs circulants et discutons l’intérêt de la nouvelle voie de recherche sur les MP dans l’évaluation de l’ischémie cérébrale.
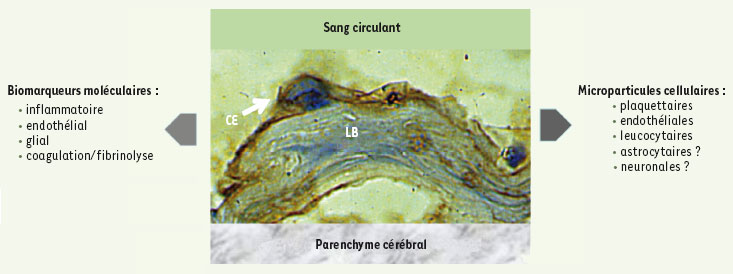
| Figure 1.
Biomarqueurs plasmatiques et microparticules cellulaires. Schéma de la microcirculation cérébrale montrant la couche de cellules endothéliales (CE) en contact avec le sang circulant et la lame basale (LB) voisinant avec le parenchyme cérébral. La cellule endothéliale est marquée par un anticorps monoclonal anti-tPA (tissue plamsinogen activator) couplé à la peroxidase [
29]. L’activation de la coagulation, du système fibrinolytique, de cellules sanguines, endothéliales et gliales se manifeste par la formation ou la libération de molécules témoignant de la lésion neurovasculaire. Ces cellules activées peuvent également émettre des microparticules cellulaires, messagers et témoins de la lésion. |
| Tableau I.
Méthodes de détection des microparticules.
|